Výzkum odhalil detaily fungování enzymu, který reguluje sodík v těle
03. 06. 2025
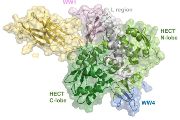
Mechanismus regulace enzymu E3 ubikvitin ligasy Nedd4-2 poprvé podrobně popsal tým Veroniky Obšilové z Fyziologického ústavu AV ČR a Tomáše Obšila z katedry fyzikální a makromolekulární chemie Přírodovědecké fakulty Univerzity Karlovy. Studie vyšla v prestižním časopise Nature Communications.
Sodík je životně důležitý prvek, ale jeho nadbytek tělu škodí – způsobuje například zadržování vody v organismu, otoky nebo zvýšený objem krve. Zásadní roli v regulaci hladiny sodíku hraje enzym Nedd4-2: kontroluje odstraňování sodíkových kanálů z buněčných membrán. To je klíčové pro regulaci krevního tlaku a osmotické rovnováhy, tedy vyvážené koncentrace látek pohybujících se mezi buňkami a okolím. Porucha regulace totiž souvisí s onemocněními, jako jsou vysoký krevní tlak, choroby ledvin či některé druhy rakoviny.
V nové studii tým z Fyziologického ústavu AV ČR a Přírodovědecké fakulty Univerzity Karlovy poprvé detailně popsal strukturu celého enzymu Nedd4-2 a vysvětlil mechanismus jeho regulace. „Pomocí pokročilých zobrazovacích a biochemických metod jsme zjistili, že funkce Nedd4-2 je blokována vzájemnými interakcemi jeho domén, to je částí enzymu se specifickou úlohou a strukturou,“ říká Veronika Obšilová z Fyziologického ústavu AV ČR, korespondující autorka zveřejněné studie.
Enzym podle ní zůstává neaktivní, dokud se v přítomnosti vápníkových iontů nenaváže na buněčnou membránu. To vede k uvolnění mezi-doménových interakcí a k aktivaci enzymu Nedd4-2.
Studie také prokázala, že na regulaci Nedd4-2 se dále podílejí i proteiny 14-3-3, které reagují na hormonální signály a svojí vazbou blokují jak enzymatickou aktivitu Nedd4-2, tak i jeho schopnost vázat se na membránu.
Odkaz na publikaci:
Masa Janosev, Dalibor Kosek, Andrej Tekel, Rohit Joshi, Karolina Honzejkova, Pavel Pohl, Tomas Obsil* & Veronika Obsilova*. Structural basis of ubiquitin ligase Nedd4-2 autoinhibition and regulation by calcium and 14-3-3 proteins. Nature Communications 16:4875 (2025). DOI: 10.1038/s41467-025-60207-4.
(* shared corresponding authorship)
https://www.nature.com/articles/s41467-025-60207-4
Kontakt:
RNDr. Veronika Obšilová, Ph.D.
Fyziologický ústav AV ČR
veronika.obsilova@fgu.cas.cz
+420 773 752 351
Přečtěte si také
- Mapy zobrazující intenzitu sucha bude Intersucho nově aktualizovat denně
- Riziko horkých vln se zvyšuje; nový monitorovací a předpovědní web
- Čeští vědci představí výsledky svého výzkumu nejznámějšího zlomu na světě
- Ve čtvrtek se Letňany otevřou tomu nejzajímavějšímu z výzkumu
- Web Agrorisk varuje před rizikem tepelného stresu pro skot i pro ryby
- Blízcí příbuzní prvních eukaryot využívají světlo jinak, než se doposud myslelo
- Největší evropská konference o výzbroji a výstroji Římanů začne v Brně
- Neznámé molekuly objevují s pomocí AI vědecké týmy ÚOCHB a ČVUT
- Mezinárodní konference o vysokoenergetické astrofyzice
- Medaile AV ČR obdrželi historici a parazitolog
Kalendář akcí
Kontakt:
 Viktor Černoch
Viktor Černoch
vedoucí Odboru akademických médií
e-mail: cernoch@ssc.cas.cz
telefon: +420 221 403 531
mobil: +420 776 792 474